
Bent u klant bij ons of wilt u zich om een andere reden tot ons wenden? Wij zien uw Nieuwsbericht graag tegemoet en zullen per omgaande reageren.
U kunt ook direct contact opnemen met één van onze Vestiging of met ons hoofdkantoor
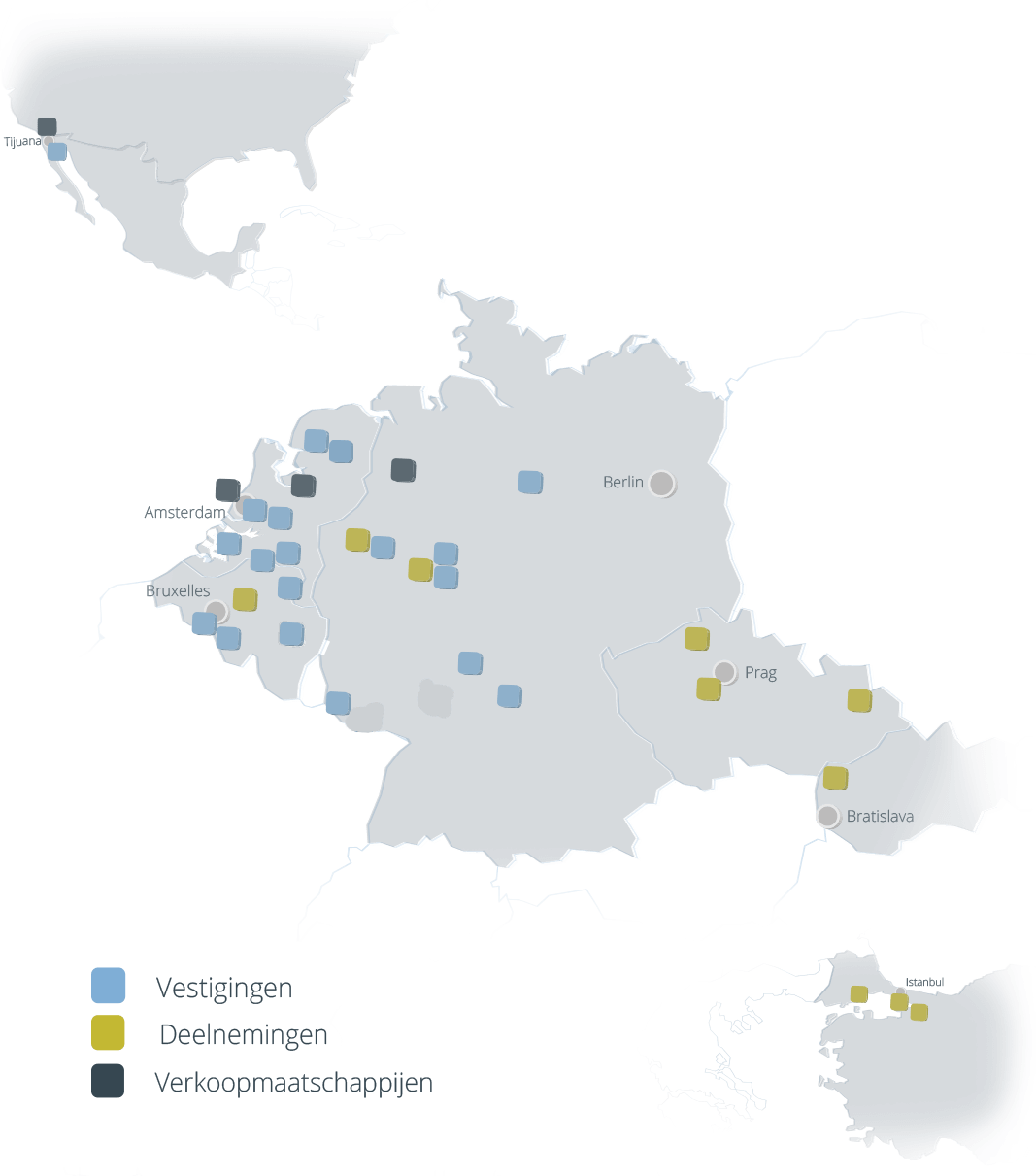
Het Coatinc-netwerk
The Coatinc Company Holding B.V.
Edisonweg 5
2952 AD Alblasserdam
Nederland
Telefoon: +31 78 6992283
The Coatinc Company Holding B.V.
Edisonweg 5
2952 AD Alblasserdam
Nederland
Telefoon: +31 78 6992283
The Coatinc Company Holding B.V.
Edisonweg 5
2952 AD Alblasserdam
Nederland
Telefoon: +31 78 6992283
Telefax: +31 78 6913496
Uw contactpersoon:
Jessica Hoek – van der Zande
j.vanderzande@coatinc.com
Kennisgever 5:
In de atmosfeer spelen zich twee processen (redocfenomenen) tegelijk af: de chemische en de elektrochemische corrosie. Corrosie als redoxfenomeen houdt verband met de elektrochemische processen en wordt daarom ook als “elektrochemische fasegrensreactie” aangeduid. Men kan deze reacties tegengaan door de afgifte van ijzer-ionen of van elektronen te verhinderen, want redoxreacties berusten op een elektronenoverdracht. Het metaal gaat daarbij over in zijn ionen. Vooral bij de gezamenlijke verwerking van verschillende metalen ontstaat bij de contactpunten tussen deze metalen sneller corrosie. De volgende formule is van toepassing: hoe hoger het redoxpotentiaal, des te edeler is het metaal. hoe lager het redoxpotentiaal, des te onedeler is het metaal. De ionen van de edelmetalen goud, zilver, kwik of platina nemen gemakkelijker elektronen op dan de ionen van zink, aluminium of magnesium.
Anode:
– Oxidatie
– Elektronen in het metaal
– Metaal laadt zich negatief op t.o.v. de elektroliet
– Potentiaal elektroliet boven dat van het metaal
– Materiaalafbraak, corrosie
Kathode:
– Reductie
– Elektronen uit het metaal
– Metaal laadt zich positief op t.o.v. de elektroliet
– Potentiaal elektroliet onder die van het metaal
Aus Gründen der besseren Lesbarkeit verzichten wir auf die gleichzeitige Verwendung der Sprachformen männlich, weiblich und divers (m/w/d). Sämtliche Personenbezeichnungen gelten daher gleichermaßen für alle Geschlechter.
