Phénomène redox – Réduction et oxydation

Vous êtes déjà client ou souhaitez nous contacter pour un autre sujet ? Nous nous réjouissons de votre message et nous y répondrons dans les meilleurs délais !
Vous avez également la possibilité de prendre contact directement avec l’un de nos sites ou de vous adresser à la holding pour les demandes internationales.
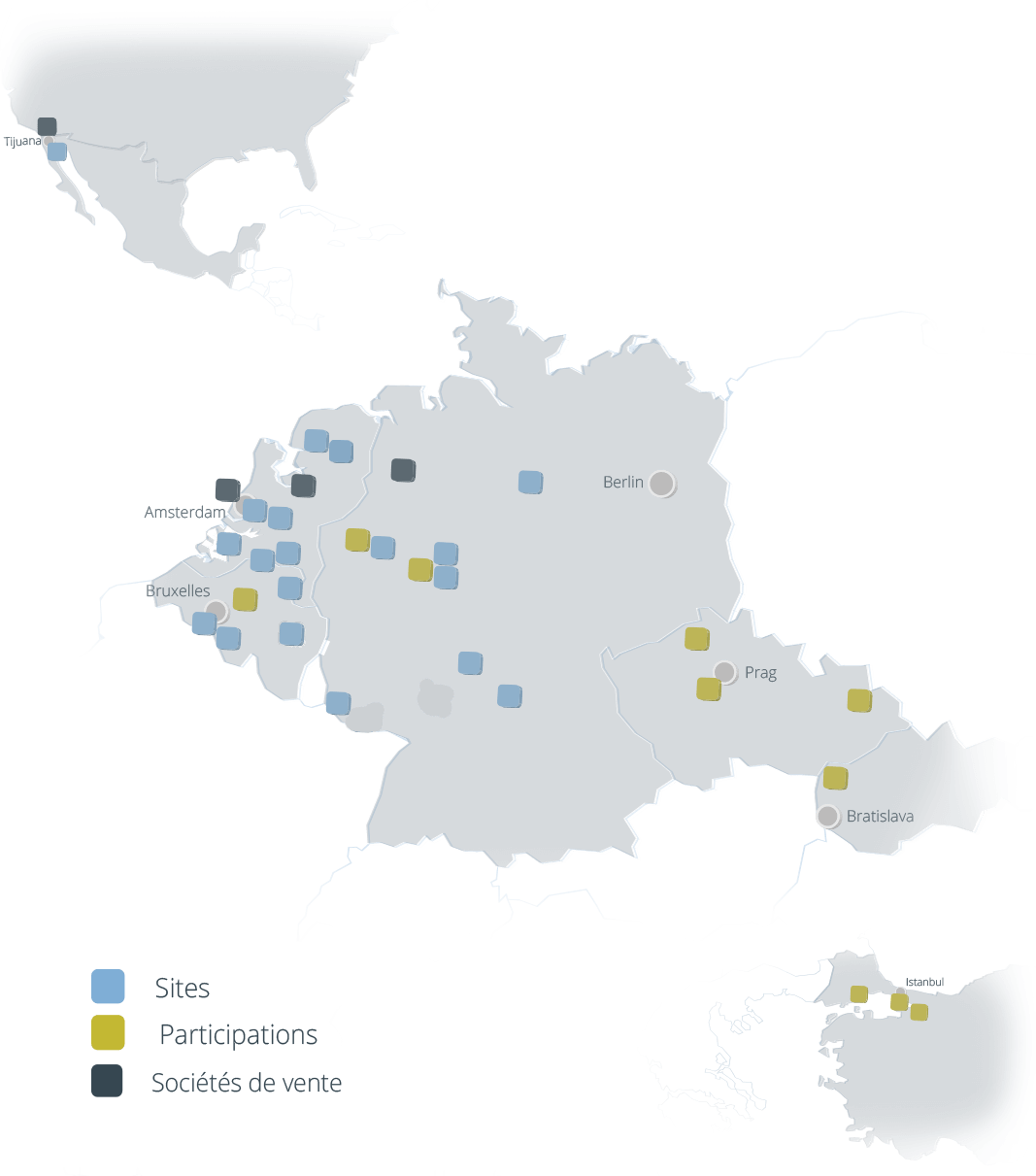
Lieux
Le Réseau Coatinc
Slovakia
Pays Bas
- Alblasserdam / NL
alblasserdam@coatinc.com - Amsterdam / NL
amsterdam@coatinc.com - Barneveld / NL
nederland@coatinc.com - De Meern / NL
demeern@coatinc.com - Groningen / NL
groningen@coatinc.com - Groningen – Pulverbeschichtung / NL
cgr.verkoop@coatinc.com - Mook / NL
mook@coatinc.com - Mook – PreGa / NL
prega.nl@coatinc.com - Roermond / NL
roermond@coatinc.com - Scherpenzeel / NL
anox@coatinc.com
États-Unis
Pour toute demande relative au marketing ou à la presse, veuillez vous adresser aux contacts suivants :
Commercialisation & Presse
The Coatinc Company Holding GmbH
Hüttenstraße 45
57223 Kreuztal
Allemagne
Votre interlocuteur
Anna-Maria Ademaj
marketing@coatinc.com
Holding
Siege de la direction
The Coatinc Company Holding GmbH
Carolinenglückstraße 6-10
44793 Bochum
Allemagne
Téléphone: +49 234 52905-0
Fax: +49 234 52905-15
Lexique
Phénomène redox – Réduction et oxydation
Phénomène redox – Réduction et oxydation
Dans l’atmosphère, deux procédés (phénomènes redox) se produisent simultanément : la corrosion chimique et la corrosion électrochimique. La corrosion en tant que phénomène redox est liée aux processus électrochimiques et est par conséquent connue sous le nom de réaction électrochimique à la limite de phases. On peut lutter contre ces réactions en empêchant la restitution d’ions de fer ou d’électrons, car les réactions redox reposent sur un transfert d’électrons. Le métal est donc transféré dans ses ions. Une corrosion se forme donc plus rapidement au niveau des points de contact de ces métaux, en particulier lorsque l’on transforme ensemble des métaux différents. Le principe suivant s’applique : plus le potentiel redox est élevé, plus le métal est noble. Plus le potentiel redox est faible, moins le métal est noble. Par exemple, les ions des métaux précieux comme l’or, l’argent, le mercure ou les ions de métaux à base de platine sont plus disposés à recevoir des électrons que les ions du zinc, de l’aluminium ou du magnésium.
Anode :
- Oxydation
- Électrons dans le métal
- Le métal se charge de manière négative par rapport à l’électrolyte.
- Le potentiel de l’électrolyte est supérieur à celui du métal
- Enlèvement, corrosion
Cathode :
- Réduction
- Électrons issus du métal
- Le métal se charge de manière positive par rapport à l’électrolyte.
- Le potentiel de l’électrolyte est inférieur à celui du métal



